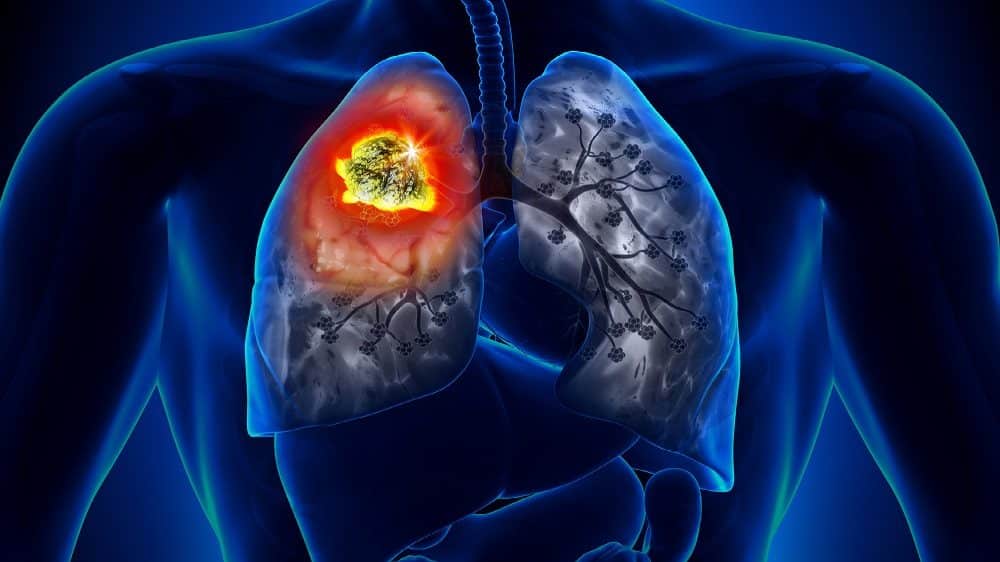
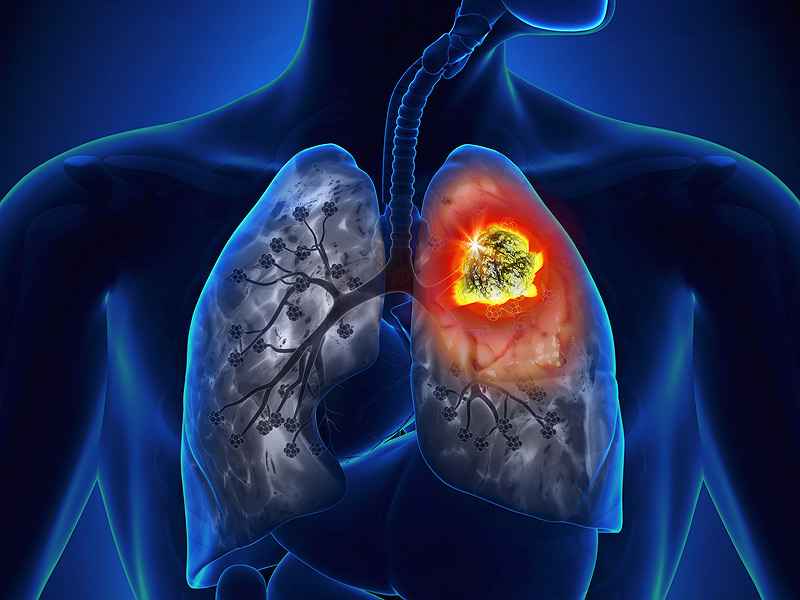
A Food and Drug Administration concedeu aprovação acelerada ao Exkivity para o tratamento de pacientes adultos com câncer de pulmão de células não pequenas - localmente avançado ou metastático (NSCLC), com receptor do fator de crescimento epidérmico (EGFR) e mutações de inserção do exon 20 detectadas por teste. A aprovação ao medicamento é destinada aos casos onde a doença progrediu durante ou após a quimioterapia à base de platina.
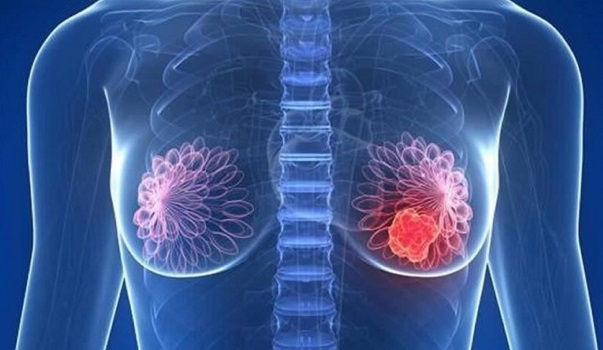
Produzido pela Roche Químicos e Farmacêuticos S.A., o Kadcyla é destinado ao tratamento de pacientes com câncer de mama, com receptores positivos para a proteína HER2. A indicação é para pacientes que apresentem metástases ou câncer avançado, quando não há indicação de cirurgia e/ou quando os receptores para a proteína HER2 apresentem doença residual invasiva, neste caso, após um tratamento neoadjuvante baseado em taxano e trastuzumabe, substâncias ativas que combatem o Câncer de mama.
No último dia 29 de outubro, a Food And Drugs Administration (FDA) concedeu a aprovação acelerada do Scemblix para o tratamento de leucemia mieloide crônica positiva para o cromossomo Philadelfia em fase crônica. A aprovação se refere a pacientes previamente tratados com dois ou mais inibidores da tirosina quinase, adultos com o tipo crônico da doença - cromossômica positiva em fase crônica com a mutação T315I.
Produzido pela Gilead Sciences Ireland UC., o medicamento, o Trodelvy foi analisado no programa de avaliação acelerada da European Medicines Agency, que, em outubro deste ano, concedeu um parecer favorável, recomendando a concessão de uma autorização de introdução ao mercado europeu. Destinado ao tratamento de pacientes com câncer de mama triplo-negativo irressecável ou metastático, Trodelvy está disponível na forma de 200 mg de pó concentrado para solução para perfusão.
Destinado a pacientes com câncer de bexiga e câncer do trato urinário - que tenha se espalhado ou não pode ser removido por cirurgia - o Padcev é um poderoso medicamento aprovado pela Food And Drugs Administration. Produzido pela Astellas Pharma US, Inc. e Seagen Inc, o medicamento tem o slogan "definindo nossas visões, viver mais tempo", uma afirmação baseada em um estudo sobre a sobrevida global média dos pacientes, comprovada em um estudo que o comparou com a quimioterapia.
Indicado para pacientes com linfoma difuso de grandes células B, o tipo mais comum de linfoma não Hodgkin - que corresponde a cerca de 30% dos casos - o Zynlonta demonstrou eficácia no tratamento de pacientes adultos com linfoma recidivante ou refratário de linfoma, após duas ou mais linhas de terapia sistêmica. Aprovado pela Food And Drug Administration, órgão regulador de medicamentos nos Estados Unidos, o Zynlonta é administrado por injeção, como um liofilizado em pó, comercializado em um frasco para injetáveis de dose única.
A Food and Drug Administration, agência do Departamento de Saúde e Serviços Humanos dos Estados Unidos, concedeu aprovação ao Aduhelm para o tratamento de Alzheimer. Produzido sob a substância ativa aducanumab, o medicamento recebeu aprovação acelerada - destinada a medicamentos dedicados a doenças sérias e que provocam risco de morte - por se mostrar eficaz no tratamento para amenizar os sintomas da doença debilitante que afeta mais de 6,2 milhões de americanos por ano.
Produzido sob a substância ativa pirfenidona, o Esbriet é um dos medicamentos há mais tempo aprovados pela European Medicines Agency, órgão regulador de medicamentos na União Europeia, para o tratamento de Fibrose pulmonar idiopática (FPI). Comercializado pela Roche, o Esbriet recebeu a autorização de introdução ao mercado em 2011, após rigorosa análise do Comité dos Medicamentos para Uso Humano (CHMP), que constatou a eficácia no tratamento de adultos com a doença. Antes disso, em 2004, o Esbriet foi considerado medicamento órfão, aprovação com urgência para doenças consideradas raras, como a FPI.
Produzido sob a substância ativa alectinib, o Alecensa é um dos mais importantes medicamentos na luta contra o câncer de pulmão. Prova disto é que, em fevereiro de 2017, recebeu a aprovação da European Medicenes Agency (EMA) para o tratamento do câncer de pulmão de células não pequenas (NSCLC). A validação para comercialização na União Europeia se deu para casos em que a doença já está avançada e não foi tratada anteriormente, ou mesmo tratada com o medicamento Xalkori (crizotinibe), mas sem apresentar remissão.
Produzido sob a substância ativa fumarato de dimetilo, o Tecfidera recebeu aprovação da European Medicines Agency (EMA) para tratamento de pacientes com esclerose múltipla, doença crônica, neurológica, que é progressiva e autoimune - ou seja, quando as células de defesa do nosso corpo atacam o próprio sistema nervoso provocando lesões no cérebro e na medula. A substância ativa do Tecfidera, o fumarato de dimetilo, atua na ativação de uma proteína chamada 'Nrf2', responsável por regular certos genes que produzem antioxidantes que protegem as células de danos provocados pela EM.